Coordinador y autores: Arístides de Alarcón González1, Guillermo Martín1, Antonio Ortiz Carrellán2, Eduardo Arana2, Kambiz Rezaei3 y Encarnación Gutiérrez Carretero3
Unidades Clínicas: UCEIMP1 S. de Cardiología2 y S. de Cirugía Cardiaca3.
Introducción:
Las infecciones sobre DEEC son cada vez más frecuentes. Los continuos avances de la electrofisiología han ampliado sus indicaciones a pacientes cada vez más añosos y con comorbilidades, y por tanto más susceptibles de sufrir esta complicación. Su incidencia varía de 1-3 por cada 100 implantes/recambios en marcapasos (MP) y 3-6 por cada 100 dispositivos más complejos como los desfibriladores automáticos implantables (DAIs) o las terapias de resincronización cardiaca (TRC). Los factores de riesgo que favorecen su infección son la comorbilidad (insuficiencia cardiaca, insuficiencia renal, uso de esteroides, diabetes mellitus), el desarrollo de hematoma tras implante (generalmente por la reinstauración precoz del tratamiento anticoagulante), la necesidad de re-intervención tras el implante (por ej, por dislocación del cable) y el número de recambios anteriores, ya la mayoría de los dispositivos se infectan no en el implante inicial, sino en los sucesivos recambios de generadores (agotamiento de la bateria) y/o cables posteriores (por fallo o por “actualización” de la indicación). También influye la complejidad del dispositivo, ya que DEEC más complejos tardan más en implantarse, estando más tiempo la herida expuesta a la colonización de microrganismos procedentes de la piel de zonas adyacentes (fosa pectoral y axila).
Clasificación:
Atendiendo a su localización distinguimos:
- Infecciones locales: Son aquellas que se manifiestan exclusivamente como síntomas en la bolsa del generador como: dehiscencia de sutura y exudación purulenta en un DEEC recién implantado (muy evidentes) pero también por molestias locales que dan paso luego a inflamación-fluctuación del bolsillo y también a la aparición de un orificio fistuloso por donde drena material purulento o seroso y en otras a simple extrusión del dispositivo (parcial o a veces completa, con salida del dispositivo al exterior). Están ausentes la fiebre, la elevación de reactantes de fase aguda y los hemocultivos son negativos.
- Infecciones sistémicas: Es cuando la infección afecta a los cables, bien por progresión desde una infección local del bolsillo (hablaremos entonces de afectación de generador y cables) o bien por siembra secundaria a través del torrente sanguíneo de los cables (en este caso estarán ausentes los signos del generador y hablaremos de infección solo de los cables). En estos casos hay fiebre, deterioro del estado general, embolismos pulmonares y en ocasiones afectación de territorios a distancia (espondilodiscitis y/o endocarditis izquierda). Los hemocultivos son casi siempre positivos de manera continua y suelen existir vegetaciones en los cables y a veces también sobre la válvula tricúspide (a través de la cual pasan éstos).
A su vez, teniendo en cuenta la secuencia temporal, podremos dividirlas en:
1.- Agudas: aquellas que se manifiestan antes de 30 dias desde el implante o manipulación: suelen reconocerse fácilmente por los signos llamativos signos inflamatorios a nivel de bolsa
2.- Diferidas: Entre 1 y 12 meses: las más frecuentes y a veces muy silentes, con tan solo “molestias” en bolsa que van paulatinamente aumentando en importancia
3.- Tardías: Más de 12 meses. La importancia de esto estriba en que, con un lapso de tiempo tan prolongado, si no hay claras manifestaciones locales sobre la bolsa, es posible que no se piense en este diagnóstico ante una fiebre prolongada (y no siempre constante, sino intermitente) y no focalizada en un paciente portador de un DEEC.
Microbiología:
Cualquier microorganismo puede producir una infección del DEEC, pero la etiología habitual la conforman los microrganismos existentes en la piel, que van a contaminar la herida quirúrgica: S. epidermidis y otros estafilococos coagulasa-negativos (SCN, 50%), S. aureus (20%) y C. acnes (10%). En casos de desarrollo de hematoma sobre el implante, habrá que añadir además los bacilos gram-negativos (BGN) que suponen un 10%. La etiología es responsable en gran manera de la clínica y así, S. aureus y BGN se manifiestan casi siempre de manera aguda, mientras que S. epidermidis y C. acnes producen infecciones con manifestaciones diferidas o muy tardías.
Pruebas diagnósticas:
Cultivos locales de la herida: Deben de realizarse siempre cuando hay secreción al exterior. En caso de inflamación de la bolsa sin salida al exterior, puede realizarse PAAF de la bolsa, procesando siempre la muestra para aerobios y anaerobios, con incubación prolongada (C. acnes). La rentabilidad no obstante no va más allá del 60-70%, dado que al envolverse los microorganismos en el biofilm formado sobre el material extraño, no siempre hay formas viables fuera de este entorno y lo que vemos en la secreción son leucocitos, con apenas formas bacterianas que luego puedan recuperarse en el cultivo. La norma es que cuanto más crónica es una infección, más difícil es saber qué la produce.
Hemocultivos: Van a ser casi siempre positivos de manera continua en las infecciones sistémicas, por lo que debe solicitarse una tanda de hemocultivos seriados (3 extracciones, una cada 30 minutos) sin necesidad de fiebre y lo normal es que todos los frascos exhiban crecimiento. Sin embargo, en infecciones de largo tiempo de evolución (>12 meses), con formación de importante biofilm sobre el cable, puede que solo sean positivos y por breve tiempo (30 minutos) tras el pico de fiebre. Es importante además avisar al laboratorio de Microbiología porque hasta en un 20% las infecciones son polimicrobianas y el aislamiento en unos pocos frascos (dos o a lo sumo 4) de varias especies de estafilococos coagulasa-negativos puede inducir al laboratorio a pensar que estamos ante una contaminación y desechar (y a veces hasta no informar) la muestra.
Cultivos de los cables extraídos: Son las muestras de la que se obtienen más rendimiento, tanto en las infecciones locales, como en las sistémicas, al ser los portadores del mayor inoculo bacteriano. Técnicas como la sonicación aumentan mucho el rendimiento y en caso de negatividad por tratamientos antimicrobianos previos prolongados, pueden emplearse técnicas genómicas (RNAr16S uiversal) si se desea conocer la etiología (lo cual es siempre recomendable). El inconveniente es que solo dispondremos de ellos tras la extracción.
Ecocardiografía: El rendimiento de la técnica transtorácica (TT) es muy bajo (inferior al 30%), por lo que su hay sospecha de infección sistémica debe siempre solicitarse una ecocardiografía transesofágica (TE) cuyo rendimiento va a ser del 60%. Es decir, la no visualización de vegetaciones sobre el cable o la válvula tricúspide no excluye el diagnostico de infección. Por otro lado, es preciso resaltar que hasta el 12% de los DECC no infectados pueden mostrar imágenes filiformes adheridas a los cables, por lo que el diagnostico ha de ser siempre el resultante de la suma de la clínica y las pruebas complementarias.
PET-TAC: En situaciones de duda, puede ayudar a diagnosticar una infección local con pocos signos aparentes (captación del generador) o incluso sistémica (captación en los cables). No sirve de mucho en DEEC recién implantados (hay captación entre 2 y 8 semanas) y también puede negativizarse si el paciente recibe tratamiento antimicrobiano.
Tratamiento:
1.- Tratamiento antimicrobiano:
Puede obviarse en las infecciones locales que no sean por S. aureus o BGN y es imprescindible que sea dirigido (no hay que tener prisa nunca por tratar). En las infecciones agudas (menos de un mes de evolución) tiene una eficacia de casi el 50% si se elige el antimicrobiano adecuado y con duración prolongada (3-4 semanas), ya que el biofilm aún no está maduro. Transcurrido este tiempo, el fracaso es la norma.
En las infecciones sistémicas en cambio es fundamental y debe darse a dosis altas (casi siempre por vía IV) para sortear la situación de sepsis y asegurar la posibilidad de recambio en un solo tiempo (leer más abajo). Como orientación pueden leerse las pautas recomendadas para la endocarditis infecciosa en estas guías.
2.- Tratamiento quirúrgico:
Debe realizarse siempre, tanto en infecciones locales como sistémicas, la retirada completa del sistema. En infecciones locales La tasa de fracasos con una cirugía local que realice un simple desbridamiento con recambio del generador (hecho muy habitual y generalmente denominado “reprofundización” ya que el generador amenaza con salir a la superficie), es superior al 80%, con el riesgo añadido de acabar transformando una infección local en una sistémica cuando se “reprofundiza” demasiado, ya que el pus, sin una salida “natural” (el orificio fistuloso crónico a piel), acaba progresando a través de los cables y se introduce en el sistema vascular, originando la situación de septicemia.
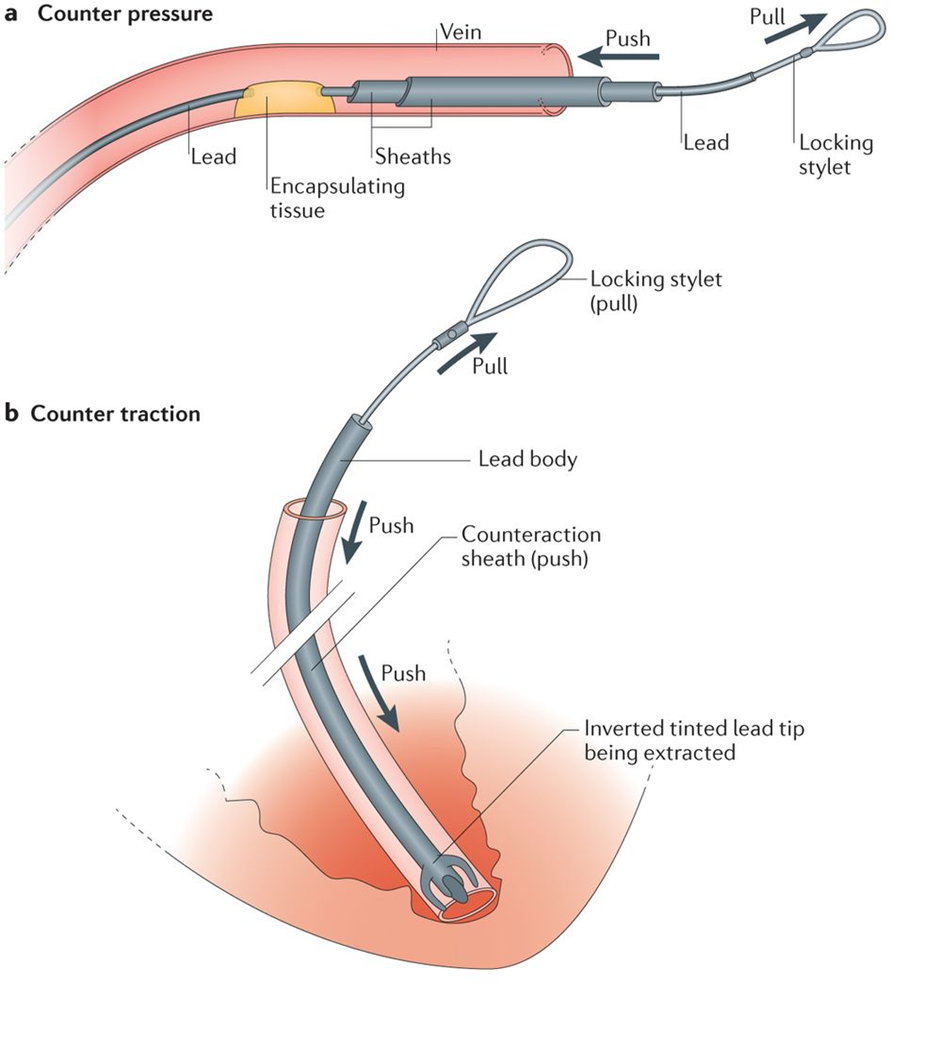
La técnica de elección es sin duda la tracción percutánea (TPC) que en manos expertas tiene una tasa de éxito de casi el 98% y una mortalidad inferior al 1%. Consiste en la liberación de los cables (que con el tiempo se adhieren cada vez más al endocardio y, sobre todo, a las paredes de las grandes venas) mediante un estilete tractor (figura 1) que se introduce a través del cable del dispositivo y sirve de guía para las vainas de disección (figura 2) que irán separando el cable de sus adherencias al territorio venoso. Estas vainas que son flexibles y dobles telescopadas, van por fuera del cable y producen su efecto mediante la separación de las adherencias que se logra parcialmente con la externa y el corte de la punta de la vaina interna. Pueden ser mecánicas auto-rotatorias (se activan mediante el disparo mecánico del operador, a través de un gatillo) o potenciadas mediante un generador externo (electro-frecuencia o láser). En ocasiones es preciso progresar hasta la misma inserción de los cables en el endocardio, tirando y empujando a la vez con la vaina externa para evitar la eversión del ventrículo derecho en un proceso que se denomina contra-tracción (figura 3). El procedimiento se realiza en un quirófano de cirugía cardiaca con anestesia general (paciente intubado, ventilado mecánicamente y con monitorización invasiva) y control del proceso mediante radioscopia y ecografía TE.
La probabilidad de éxito va a depender de:
1.- Lado de implante: siempre son más difíciles los implantes realizados por el lado derecho, por la curvatura existente entre subclavia y Vena Cava Superior
2.- Fijación de los electrodos al endocardio: pasiva (es decir, la punta del electrodo, en forma de arpón, está “enrededada” entre las trabéculas del VD) ó activa (mucho mejor, ya que la fijación es en ocasiones reversible y con menos superficie de adherencia)
3.- Años de implante y tipo de dispositivo: esto es así porque las bovinas de los DAIs generan adherencias muy intensas a partir de los 5 años, mientras que los MP pueden sacarse con relativa facilidad hasta los 10 años. El tiempo de implante también influye decisivamente sobre la resistencia del cable a la tracción (“fatiga” del metal), haciendo más fácil su rotura.
4.- Experiencia del operador: el procedimiento es complejo y precisa de una habilidad notable, por lo que son precisas unas 50 extracciones (1-2 años de entrenamiento) hasta dominar bien la técnica, y por esta razón está accesible en muy pocos centros de nuestro país.
Hay dos grandes complicaciones que son: el desgarro venoso en vena subclavia-vena innominada y su desembocadura en Vena Cava Superior, donde asientan la mayoría de las adherencias, ya que el cable suele “acostarse” en ese sitio y el desgarro de aurícula ó de ventrículo derecho. En estos casos hay que pasar siempre rápidamente a la cirugía cardiaca abierta para reparar el desgarro que producirá la muerte del paciente por shock hipovolémico y/o taponamiento pericárdico.
Otras complicaciones menores son:
- Trombosis venosa profunda del sistema venoso: Comprensible, ya que al despegar los cables de su intensa adherencia a la vena, va a producirse daño endotelial y activación del fenómeno trombótico. Afortunadamente no trae más consecuencias y suele haber repermeabilización parcial al cabo de un año.
- Embolias pulmonares: Pueden producirse al desprenderse la vegetación adherida al cable durante la tracción. Se da en vegetaciones mayores de 2 cms, pero esto no es una contraindicación para la TPC, ya que suelen ser bien toleradas.
- Daño en la tricúspide: No es frecuente, pero puede pasar, bien por tracción inadecuada del cable que tenga adherencias a las valvas o bien por el corte inadvertido de la vaina de disección al pasar por ellas. Si la rotura origina una regurgitación masiva puede que sea necesaria la reparación quirúrgica.
- Hemo-pneumotórax: en general, no suele ser importante. Es aconsejable no obstante realizar una Rx de tórax a las 12 – 24 h del procedimiento.
En el caso mucho más frecuente de rotura de cable sin más complicaciones, puede abordarse la extracción de los fragmentos rotos mediante asas y lazos introducidos por vía femoral. En los casos en que no logremos el éxito y se trate de una infección sistémica habrá que recurrir a la cirugía cardiaca abierta si el fragmento abandonado mide más de 4 cms y contiene silicona (aislamiento habitual de la espiral del cable). Si se trata de una infección local que no lleve más de un año de evolución podemos adoptar una actitud expectante, con seguimiento estrecho del paciente, ya que el fragmento retenido pudiera estar ya “colonizado” (a pesar de no haber habido manifestaciones sistémicas previas) y con el paso de varios meses (o incluso años), empezar a dar manifestaciones de infección sistémica (fiebre recurrente de foco no conocido). Algunos dispositivos han sido diseñados tan “a conciencia” para que no se muevan, que de hecho es prácticamente imposible extraerlos (por ejemplo cables con “anclaje” en seno coronario).
Recolocación del dispositivo:
No todos los dispositivos son necesarios (a pesar de lo que parecía inicialmente) y la tasa de no reimplantación oscila entre el 15% (España) y hasta el 40% (EEUU). En caso de que se juzgue necesario (mayoría de las ocasiones), en infecciones locales puede hacerse la reimplantación de un nuevo sistema sin problemas durante el mismo acto de extracción, eligiendo para ello el lado contralateral al dispositivo infectado. En caso de infección sistémica puede hacerse en dos tiempos, dejando un intervalo de 2-4 semanas bajo tratamiento antibiótico (recomendación de la mayoría de las guías aunque sin ningún nivel de evidencia), lo que traerá como consecuencia la implantación de un dispositivo transitorio de estimulación en los pacientes dependientes de MP, o bien realizarlo en el mismo acto si los hemocultivos de control bajo tratamiento ATB son ya negativos el día de la extracción (recomendación de esta guía). Con ello se acorta la estancia evitando el periodo “intermedio” en el que el paciente depende de un dispositivo transitorio y precisará en la mayoría de los casos encamamiento (aunque existen ya dispositivos transitorios con fijación activa que permiten mucha mayor movilidad) y también un “segundo paso” por el quirófano.
Tratamiento ATB tras la extracción:
- En las infecciones locales, si se ha hecho una buena exéresis de la bolsa del generador infectada y una hemostasia adecuada no es ni siquiera necesario darlo salvo en infecciones por S. aureus o BGN que pueden producir una dehiscencia de la sutura de la herida donde estuvo antes del implante (habitualmente se hace el cierre quirúrgico de la herida en el mismo acto, aunque hay grupos que lo realizan de manera diferida).
- En las infecciones sistémicas habrá que prolongar el tratamiento antimicrobiano tras la extracción. En infecciones por SCN o C. acnes dos semanas son suficientes e incluso la segunda puede hacerse por via oral. En el caso de S. aureus o BGN también son suficientes dos semanas, aunque si después de la extracción siguen viéndose vegetaciones (adheridas a las valvas cardiacas) ó prolongaciones filiformes en VD, AD o VCS, conocidas coloquialmente como “ghosts” (fantasmas), algunos autores recomiendan prolongarlo hasta 4 semanas.
Anticoagulación:
- Debe suspenderse siempre previo al acto quirúrgico y no es aconsejable reanudarla antes de 72 horas por el riesgo de desarrollo de hematoma sobre la zona.
- En casos de TVP no hay consenso sobre ello, pero nosotros no la aconsejamos como tratamiento, ya que una vez establecida no suele empeorar y tampoco origina fenómenos embólicos. La anticoagulación en este sentido no va a prevenir por tanto nada ni tampoco mejorar su resolución espontanea.
Prevención:
- Los pacientes de riesgo van a ser los que tienen las siguientes patologías: insuficiencia cardiaca, insuficiencia renal, toma de corticoides, diabetes mellitus. Lo ideal es tener estas patologías lo mejor controladas posible antes del implante.
- Si el paciente tiene fiebre o alguna infección activa, es preferible demorar el implante por la probabilidad de una siembra hematógena, hasta tanto no esté controlada la posible infección.
- Pacientes anticoagulados: la anticoagulación puede suspenderse entre 3 dias y 24 h (dependiendo del tipo de anticoagulante usado) antes de la intervención. Deben evitarse las “terapias puente” con heparina y realizar una monitorización estricta de los tiempos de coagulación. Con este proceder, en pacientes con alto riesgo embólico se ha demostrado incluso seguro el implante sin interrupción de la anticoagulación. En general, nosotros aconsejamos suspenderla previamente (el menor tiempo posible en casos de riesgo trombótico alto) y no reanudarla hasta pasadas 48-72 h de la extracción, con una hemostasia cuidadosa en pacientes frágiles, ya que es -con diferencia- el mayor riesgo para una infección (la sangre acumulada, no circulante, es un excelente medio de cultivo para casi cualquier microrganismo, especialmente S. aureus y BGN).
- Profilaxis ATB: es mandatoria, porque ha demostrado reducir apreciablemente el número de infecciones. Puede utilizarse cefazolina (1 g iV) y en aquellos centros con alta tasa de MR en cepas de S. epidermidis y/o S. aureus, podría utilizarse una monodosis de teicoplanina (10-12 mg/Kg).
- En pacientes con varios factores de riesgo y procedimientos complejos (implantación de varios cables), varios recambios previos, o necesidad de volver a abrir en la siguiente semana del implante (habitualmente por malfuncionamiento del sistema), la implantación de mallas antibióticas ha demostrado reducir la incidencia de infección en un 60%, por lo que es un procedimiento coste-efectivo en centros con una tasa de infección por encima del 2%.
Figura 1. Estiletes de tracción que tras introducirse dentro del cable, se expanden, garantizando una tracción sostenida del cable.
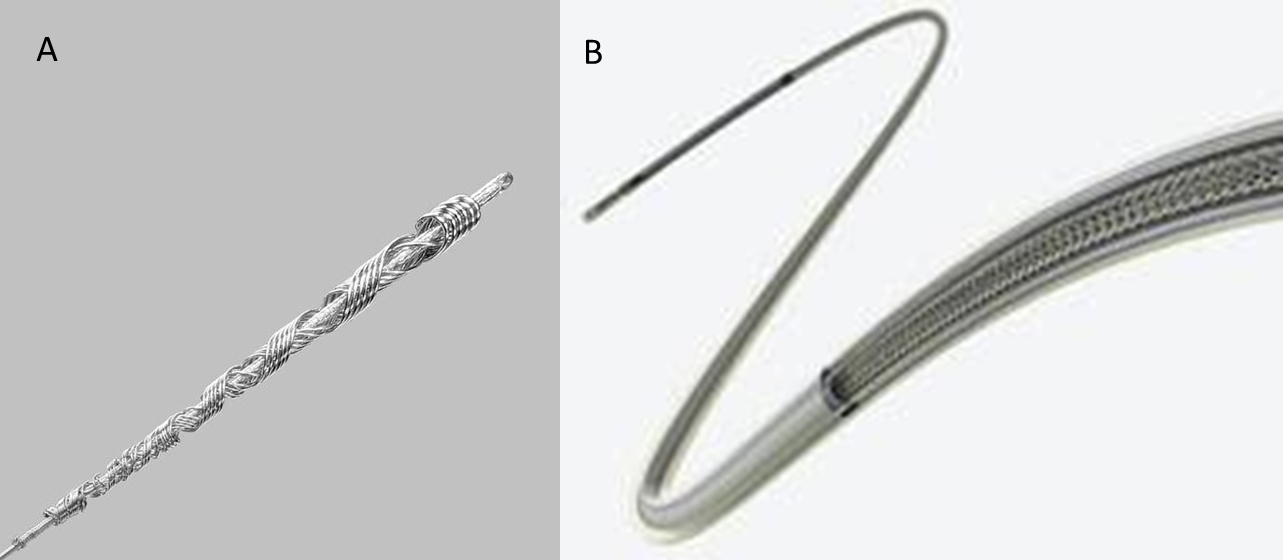 Figura 2. Vaina de disección mecánica auto-rotatoria avanzando a través de subclavia
Figura 2. Vaina de disección mecánica auto-rotatoria avanzando a través de subclavia
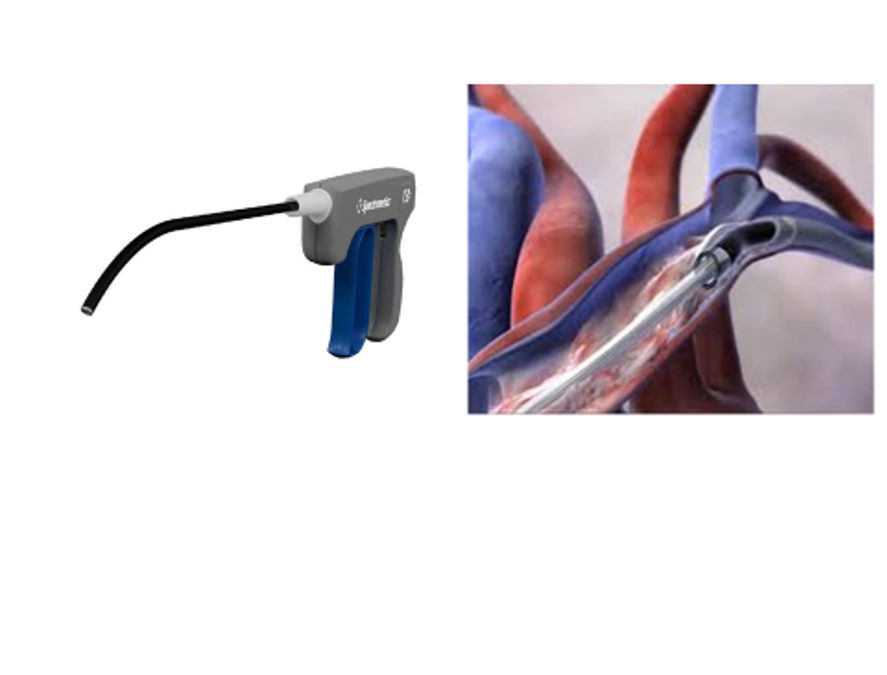 Figura 3. A) Progresión de la vaina de disección mediante tracción y avance b) Contra-tracción al llegar al VD, para evitar la eversión y facilitar el despegamiento de la punta del electrodo
Figura 3. A) Progresión de la vaina de disección mediante tracción y avance b) Contra-tracción al llegar al VD, para evitar la eversión y facilitar el despegamiento de la punta del electrodo