Autores. Marta Ferrer Galván1, Laura Carrasco Hernández1, Carmen Calero Acuña1, Rafael Luque Márquez2, Juan Francisco Medina Gallardo1, María Carmen Ruiz Gallego2, Verónica González Galán2.
1. Unidad Medico Quirúrgica de Enfermedades Respiratorias. 2. Unidad Clínica de Enfermedades Infecciosas, Microbiología Clínica y Preventiva.
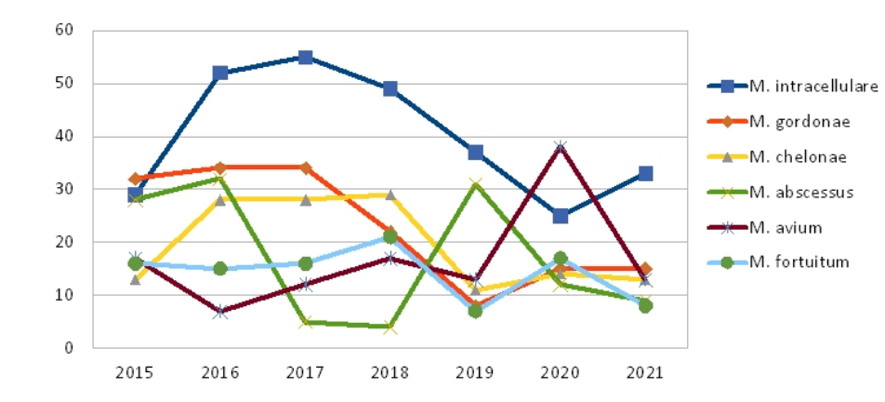
Las micobacterias no tuberculosas (MNT) constituyen un amplio grupo de microorganismos saprofíticos ambientales que causan infecciones en humanos. La correcta identificación a nivel de especie es esencial para determinar un diagnóstico definitivo y realizar una correcta elección de tratamiento. El principal reto que plantean las MNT desde el punto de vista del diagnóstico clínico, es diferenciar entre las MNT colonizantes y aquellas que producen una infección franca. En nuestro centro seguimos las recomendaciones de la American Thoracic Society donde se establecen los criterios para definir la infección por MNT y desde el año 2018 hemos constituido un grupo de trabajo multidisciplinar que nos permite un seguimiento activo de los pacientes constituido por neumólogos, infectólogos y microbiólogos. Desde la creación del grupo de trabajo se informa a los clínicos de los aislamientos para intentar confirmar con segunda muestra los casos de infección e intentar evitar la demora diagnóstica y terapéutica. La evolución temporal de los aislamientos de MNT en nuestra área se muestras en la figura 1.
Figura 1 Aislamientos de MNT en el HUVR 2015-2021
4.1 Transmisión y factores de riesgo
Las micobacterias de crecimiento lento (especialmente M. avium complex, M. kansasii) son consideradas micobacterias ambientales, ya que son aisladas en entornos naturales o asociados al hombre, como el agua (fuentes de agua potable con cloración deficitaria, piscinas, lagos, charcas, acuicultura, salas de baños) y el suelo. La prevalencia, así como las especies responsables, varía en función de la zona geográfica. No existen evidencias de la transmisión desde animales infectados al hombre y diversos estudios sugieren que la transmisión persona-persona es improbable, produciéndose la mayoría de los casos a partir de microorganismos distribuidos en el medio ambiente. La infección se produce por la inhalación de aerosoles en las infecciones respiratorias y por la vía digestiva en el caso de linfadenitis en niños y formas diseminadas de pacientes con SIDA[i].
Los principales factores predisponentes para las infecciones por MNT son la patología estructural vía respiratoria (EPOC, bronquiectasias) (30-52 %), anomalías anatómicas (pectus excavatum), fibrosis quística, enfermedades cardiacas, gastrectomía y situación de inmunodepresión. En otros casos no se llega a encontrar factor de riesgo asociado (tabla 1).
| Tabla 1. Factores de riesgo para MNT | |
| Enfermedades pulmonar predisponentes | EPOC
Bronquiectasias Fibrosis quística Infección previa por TB Proteinosis alveolar Déficit de alfa 1 antitripsina |
| Enfermedades digestivas predisponentes | Alteraciones en la motilidad esofágica |
| Morfotipo | Pectus excavatum
Escoliosis Prolapso de la válvula mitral Hipermovilidad articular |
| Abreviaturas. EPOC; enfermedad pulmonar obstructiva crónica, TB; tuberculosis. | |
4.2 Criterios clínicos y microbiológicos para el diagnóstico de MNT[i] .
Para realizar el diagnóstico de la infección por MNT, es necesario que se cumplan los criterios clínicos, radiológicos y microbiológicos, todos son igual de importante para poder realizar un correcto diagnóstico (tabla 2).
No existen hallazgos radiológicos en la radiografía o en la TC de tórax patognomónicos de esta enfermedad, no obstante, nos deben hacer sospechar de la existencia de una infección por MNT:
- nódulos milimétricos, opacidades cavitadas, imágenes compatibles con bronquiectasias en la radiografía de tórax.
- bronquiectasias multifocales, con o sin pequeños nódulos, patrón en árbol en brote, imágenes cavitadas en la TC de tórax.
En el caso de la infección por MAC los hallazgos radiológicos más frecuentes son
- cavitaciones a nivel apical del parénquima pulmonar.
- infiltrados intersticiales con nódulos en lóbulo medio y língula.
- bronquiectasias cilíndricas más nódulos.
| Tabla 2. Criterios clínicos y microbiológicos para el diagnóstico de enfermedad pulmonar por micobacterias no tuberculosas. | |
| Clínico | Síntomas sistémicos o pulmonares |
| Radiológico | Opacidades nodulares o cavitarias en la Rx tórax o TACAR que muestren bronquiectasias con múltiples nódulos pequeños. |
| y | Exclusión apropiada de otros diagnósticos |
| Microbiológico | 1. Cultivo positivo de al menos 2 muestras separadas de esputo. Si los resultados no son diagnósticos, considerar repetir el cultivo de esputo y la tinción de bacilo acidorresistente (BAAR).
ó 2. Cultivo positivo de al menos una muestra de lavado bronquial. ó 3. Biopsia transbronquial o biopsia pulmonar con hallazgos histológicos de micobacterias (inflamación granulomatosa o BAAR) y cultivo positivo para MNT o biopsia que muestre hallazgos histológicos de micobacterias (inflamación granulomatosa o BAAR) y uno o más esputos o lavado bronquial positivo para MNT. |
|
Abreviaturas Rx; radiografía. TACAR; tomografía axial computarizada de alta resolución. BAAR; bacilo ácido alcohol resistente. MNT; micobacterias no tuberculosa. |
|
Extraído de referencia 1.
4.3 Especies más frecuentes en nuestro medio y recomendaciones de tratamiento (antibiótico/dosis y duración).
- Micobacteria avium complex (MAC): son micobacterias de crecimiento lento, clasificadas como no cromógenas. Hasta la fecha, MAC contiene nueve especies de micobacterias de crecimiento lento: M. avium, M. intracellulare, M. chimaera, M. colombiense, M. marseillense, M. timonense, M. boucherdurhonense, M. vulneris, M. arosiense y un pequeño grupo de “otros MAC” no clasificados. En esta guía trataremos M.avium y M. intracellulare. Describimos a continuación la presentación de los tres tipos de infecciones MAC más frecuentes en nuestro medio:
- Infecciones pulmonares; son las más frecuentes. principalmente en pacientes con enfermedades pulmonares crónicas, como la enfermedad pulmonar obstructiva crónica (EPOC), bronquitis crónica, bronquiectasias, fibrosis quística y cáncer de pulmón. La forma de enfermedad fibrocavitaria es común en hombres fumadores mayores con síntomas pulmonares crónicos. La forma de enfermedad nodular/bronquiectasia es más común en mujeres no fumadoras mayores de 50 años con enfermedad pulmonar crónica.
- MAC diseminadas (DMAC): En aquellas personas que tiene colonización del tracto respiratorio o intestinal tienen alto riesgo de desarrollar una enfermedad diseminada. Generalmente ocurren en pacientes en etapas avanzadas de VIH/SIDA cuando los recuentos de células T CD4+ en sangre son inferiores a 50/mm3. Se desconoce el mecanismo de adquisición de las MNT en pacientes VIH. M. avium suele ser la especie más frecuente responsable de la infección diseminada en pacientes con VIH/SIDA. También se han descritos formas diseminadas en pacientes inmunodeprimidos no VIH, como en el caso de trasplantados renales o cardiacos, leucemia o tratamiento crónico con corticoides.
- Linfadenitis, principalmente cervical en niños inmunocomprometidos menores de 5 años.
El tratamiento del MAC se realiza mediante la combinación de 3 antibióticos, cuya duración es de 12-18 meses a partir de la negativización de los cultivos. El esquema de tratamiento varía en función de la presentación clínica.
Aunque de manera inicial se recomienda de forma preferente el estudio de mecanismos de resistencias in vitro a los macrólidos, debemos hacerlo de forma obligada en los casos de fracaso terapéutico (cultivo positivo a los 6 meses de tratamiento), recaída, tratamientos previos con macrólidos y aislamiento en muestras no habituales (como sangre o tejidos).
En caso de resistencia a los macrólidos, el tratamiento recomendado debe incluir la pauta habitual de rifampicina, etambutol macrólido +/- quinolona, valorando dar también un aminoglucósido en casos de gravedad.
La pauta rifampicina, etambutol, ciprofloxacino podría ser una de las recomendadas por los estudios previos, aunque las últimas guías de la BTS recomiendan la utilización de moxifloxacino (400 g/día) dentro del grupo de las quinolonas.
Otras opciones pueden incluir la asociación de cicloserina, etionamida, clofazimina, doxiciclina, cotrimoxazol o incluso delamanid en casos refractarios a la pauta estándar.
La administración de amikacina nebulizada parece ser una buena alternativa para estos casos, especialmente cuando se requiere su uso prolongado o cuando su utilización por vía intramuscular o intravenosa es impracticable.
Los casos de enfermedad pulmonar por MAC en pacientes con fibrosis quística presentan alguna peculiaridad en el tratamiento: las guías recomiendan la utilización sistemática de azitromicina como macrólido junto a rifampicina y etambutol. Al mismo tiempo recomiendan la asociación de aminoglucósidos en casos graves con una afectación pulmonar extensa y también en casos con baciloscopia positiva o si existe sintomatología sistémica.
En caso de asociar aminoglucósido, se recomienda hacerlo 3 días a la semana o con menos dosis que las recomendaciones habituales.
- M. kansasii: Siempre debemos considerarlo patógeno.
Es recomendable realizar estudio de sensibilidad a rifampicina previo al inicio de tratamiento y siempre que el tratamiento fracase. La resistencia a rifampicina se correlaciona con fracaso del tratamiento y ocasionalmente puede ocurrir de forma concomitante una resistencia a isoniacida o etambutol.
También es recomendable el estudio radiológico para descartar la existencia de enfermedad cavitaria, que se relaciona con peor pronóstico.
En cuanto al tratamiento no hay ensayos clínicos controlados que incluyan pacientes con M. kansasii; las recomendaciones de las actuales guías están extraídas de estudios observacionales prospectivos.
Es recomendable un régimen antibiótico que incluya rifampicina, ya que se asocia a una conversión más rápida del esputo y a una menor tasa de fracaso, asociada a etambutol e isoniacida o un macrólido, independientemente de la concentración mínima inhibitoria (CMI) de la isoniacida y etambutol (tabla 3). Se recomienda la vía oral para los tres fármacos, debido a la alta tasa de éxito en el tratamiento, y por presentar menos efectos adversos que los aminoglucósidos. En el caso de intolerancia a fármacos de primera línea se debe sustituir por una fluoroquinolona (ej. Moxifloxacino).
En general se recomienda un régimen diario. Excepcionalmente, en el caso de enfermedad no cavitaria, nodular o bronquiectasiante podría plantearse un régimen de 3 veces en semana.
La duración de tratamiento debe ser al menos de 12 meses. No hay evidencia de que mantener el tratamiento más de 12 meses disminuya el riesgo de recaídas.
- M.lentiflavum
M. lentiflavum es una MNT pigmentada, escotocromógena, de crecimiento lento, descrita en 1996. Crece a 25-37◦C, formando colonias de 1-2 mm de diámetro, con pigmentación amarilla.
Se han descrito casos de linfadenitis cervical en niños, infecciones en pacientes inmunocomprometidos y también en inmunocompetentes con enfermedad pulmonar crónica. Lo más frecuente es que presenten con un patrón radiológico nodular/bronquiectasiante, y en general no suelen tener un curso agresivo[1].
El régimen terapéutico óptimo y su duración no se ha establecido; debiéndose tener en cuenta que se trata de un microorganismo resistente a la mayoría de los fármacos antituberculosos. Se propone aquí un esquema de tratamiento basado en la revisión de los casos y evolución publicados hasta la fecha. Se recomienda un régimen que incluya al menos tres fármacos: macrólido (claritromicina o azitromicina), rifampicina y etambutol. Rifabutina podría ser una alternativa a rifampicina en casos de interacciones o intolerancia a rifampicina. Rifabutina tiene como ventaja que la inducción del citocromo P450 es menor lo que posibilita su uso con ajuste de dosis cuando no se puede usar rifampicina, como desventaja es más cara y presenta otros efectos adversos.
La Indicación de profilaxis primaria y secundaria frente a infección por MNT (M.avium complex, M. genavense, M.kansasii) en paciente VIH no es objeto de este capítulo. Consultar en capítulo de tratamiento de infección en el paciente inmunodeprimido.
| Tabla 3: Recomendaciones de tratamiento para MNT de crecimiento lento | |||
| Especie | Número de fármacos | Fármacos | Duración del tratamiento
|
| M. avium
M. intracellulare |
(≥3 fármacos) | a) Forma nodular o asociada a bronquiectasias: Macrólidos [claritromicina 500 mg/2 veces al día; 3 días a la semana (dosis a partir de 12 años. Si peso < 40 kg a 15 mg/kg/día vo cada 12h max 250mg cada 12h) o azitromicina 10mg/kg* (máximo 500 mg 3 días a la semana, si < 50 kg o intolerancia digestiva 250mg cada 24h)], rifampicina (600 mg, 3 veces por semana) y etambutol (25 mg/kg, 3 días por semana).
b) Forma nodular múltiple o enfermedad fibrocavitaria: pauta diaria de macrólido [claritromicina 500 mg/ 2 veces al día (dosis a partir de 12 años. Si peso < 40 kg a 15 mg/kg/día vo cada 12h, máx. 250mg cada 12h) o azitromicina 10mg/kg (máximo 500 mg, si < 50 kg o intolerancia digestiva 250mg cada 24h)], rifampicina (15 mg/kg; máximo 450 mg si peso < 50 kg; 600 mg si peso > 50 kg) y etambutol (15 mg por kg y día, valorando comenzar con 25 mg/kg los primeros 2 meses). c) Forma extensa, grave, baciloscopia positiva o diseminada: pauta previa diaria de macrólido [claritromicina 500 mg/ 2 veces al día (dosis a partir de 12 años. Si peso < 40 kg a 15 mg/kg/día vo cada 12h, máx. 250mg cada 12h) o azitromicina 10mg/kg (máximo 500 mg, si < 50 kg o intolerancia digestiva 250mg cada 24h)], rifampicina y etambutol y considerar aminoglucósido (amikacina a una dosis de 10-15 mg/kg bajando a 6-8 mg/kg en mayores de 50 años y con peso inferior a 50 kg) 3 veces en semana.
|
Mínimo 12 meses a partir de la negativización de los cultivos |
| M. kansasii | (≥3 fármacos) | Si se demuestra sensibilidad a Rifampicina: Rifampicina 15 mg/kg; (máximo 450 mg si peso < 50 kg; 600 mg si peso > 50 kg 600 mg/día), Etambutol 15 mg/Kg/día e Isoniacida 10 mg/kg/día (dosis máxima 300 mg/día. (En pacientes con bajo peso considerar disminuir la isoniacida 5 mg/kg/día). Añadir piridoxina 10 mg/día) o un macrólido diario [claritromicina 500 mg/ 2 veces al día (dosis a partir de 12 años. Si peso < 40 kg consultar dosis) o azitromicina 500 mg 10mg/kg (máximo 500 mg, si < 50 kg o intolerancia digestiva 250mg cada 24h)].
Si es resistente a Rifampicina: Etambutol 15 mg/kg/día, Azitromicina 500 mg 10mg/kg (máximo 500 mg) y fluoroquinolonas (Levofloxacino 750 mg/d o Moxifloxacino 400 mg/d).
Si existe intolerancia a algún fármaco de primera línea sustituir por fluoroquinolona. En caso de embarazo, toxicidad neuropática, al menos 150 mg día. |
Mínimo 12 meses
|
| M. lentiflavum | (≥3 fármacos) | Rifampicina 15 mg/kg/ día (máximo 450 mg si peso < 50 kg; 600 mg si peso > 50 kg 600 mg/día), Etambutol 15mg/kg/día (1.5 g máximo) y Macrólido: Claritromicina 500 mg/ 2 veces al día (dosis a partir de 12 años. Si peso < 40 kg a 15 mg/kg/día vo cada 12h, máx. 250mg cada 12h) o Azitromicina 500 mg 10mg/kg/día (máximo 500 mg, si < 50 kg o intolerancia digestiva 250mg cada 24h)]. 400 mg días alternos piridoxina | Mínimo 12 meses |
| Abreviaturas M; micobacteria, vo; vía oral, mg; miligramo, kg; kilogramo.
* https://www.seipweb.es/dosisantibióticos/ |
|||
4.4 Monitorización y seguimiento de los pacientes
La monitorización de los pacientes debe individualizarse. De forma general en los casos de infección respiratoria (forma nodular o nodular múltiple) la revisión se hace trimestralmente. En caso de infección en pacientes FQ o en los casos de infección diseminada la revisión se hace mensualmente.
Antes de iniciar el tratamiento se debe realizar una analítica con función renal y función hepática, que repetiremos cada 3 meses.
Si las transaminasas se elevan > 5 veces el límite superior de la normalidad, suspender medicación. Tras su normalización introducir los fármacos de forma escalonada. También debemos evaluar la agudeza visual antes de iniciar tratamiento con Etambutol. En la tabla 4 se describen los principales fármacos empleados, sus efectos secundarios y su monitorización.
Es recomendable la realización de un TACAR previo al inicio de tratamiento y al finalizar; las cavidades pueden persistir hasta en el 75 % de los pacientes respondedores. Si hay dudas sobre persistencia de infección a pesar de cultivos negativos se recomienda lavado bronquial dirigido por TC.
Se deben enviar muestras para cultivo de esputo cada 4 semanas durante el tratamiento y hasta 12 meses después de completarlo. En individuos incapaces de expectorar se recomienda lavado bronquial dirigido por TC a los 6 y 12 meses de tratamiento.
| Tabla 4: Efectos adversos de los fármacos empleados en el tratamiento de MNT de crecimiento lento y monitorización. | |||||
| Fármaco | Efecto adverso | Monitorización clínica | Monitorización analítica | Interacciones (las más graves y fármacos más frecuentes) | Embarazo y lactancia |
| Azitromicina | GI (dolor abdominal, náusea, vómito, diarrea, dispepsia), dolor de cabeza, alteraciones visuales. Raros: pérdida de audición, prolongación de QT. | Considerar audiometría, ECG, efectos GI | ALT, hemograma, creatinina (al mes, los 3 meses y luego anualmente) * | Warfarina: monitorizar INR
Derivados ergotamínicos |
Probablemente seguro en embarazo
Evitar lactancia materna |
| Claritromicina | GI (dolor abdominal, náusea, vómito, diarrea, dispepsia, alteraciones en el gusto) | Considerar audiometría, efectos GI, ECG, vigilar interacción medicamentosa) | Hemograma, ALT, creatinina (al mes, 3 meses y luego anualmente) * | Teofilina, tacrolimus, Simvastatina, Sildenafilo, Rifabutina, Rifampicina, Derivados ergotamínicos, digoxina, Warfarina, carbamazepina, itraconazol, colchicina, verapamilo, cisaprida, Pimozide y Terfenadina | Evitar en el primer trimestre
Evitar lactancia materna |
| Ciprofloxacino | GI (dolor abdominal, náusea, vómito, diarrea, dispepsia), hipoglucemia, efectos neurológicos ( agitación, nerviosismo, desorientación, pérdida de memoria), rash.
Raros: Neuropatía periférica, rotura de tendón, prolongación QT. |
Considerar ECG, signos de hipoglucemia, efectos SNC) | Hemograma, ALT, Creatinina (al mes, 3 meses y luego anualmente) | Agomelatina, cariprazina, amiodarona, nitrofurantoina, tizanidina, foscarnet, clopidogrel, duloxetina, lurasidona, Salmonella typhi atenuada, siponimod, sotalol. | Durante el embarazo usar solo en el caso de ausencia de alternativas terapéuticas más seguras.
Se recomienda suspender la lactancia materna y reanudarla 48 horas después del final del tratamiento. |
| Etambutol | Neuritis óptica, efectos GI (náusea/vómito).
Raros: neuropatía periférica |
Evaluación mensual de agudeza visual y rojo-verde evaluación de discriminación de color (Ishihara), examen de fondo de ojo (basal y cada 3 meses) | Creatinina basalmente y cada mes. | Benzbromarona, citisina, sulfasalazina | Desconocidos efectos sobre el embarazo
Seguro durante la lactancia |
| Isoniacida | Neuropatía periférica, hipertransaminasemia asintomática, hepatitis.
Raro: rash, reacciones de hipersensibilidad |
Signos clínicos de hepatotoxicidad (náusea, dolor abdominal, ictericia) y neuropatía. | Función hepática: AST/ALT, F.A., bilirrubina (basal y mensualmente) si hay riesgo de hepatotoxicidad por fármacos. | Alcohol, Benzbromarona, citisina, disulfiramo, fenitoína. | Durante el embarazo se ha empleado en el tratamiento de TBC.
Se considera compatible con la lactancia materna, aunque se recomiendan exámenes periódicos por riesgo de neuritis periférica y/o hepatitis en el lactante. |
| Levofloxacino | GI (náusea, diarrea), hipoglucemia, efectos sobre el SNC (agitación, nerviosismo, desorientación, alteraciones de la memoria, insomnio, mareo). Raro: neuropatía periférica, rotura de tendón, prolongación del QT. | Considerar ECG, signos de hipoglucemia, efectos del SNC. | Hemograma, ALT y creatinina ( al mes, 3 meses y anualmente). | Adenosina, apomorfina, hidroxizina, amiodarona, ivabradina, nitrofurantoina, Salmonella typhi, sotalol, vandetanib, vemurafenib. | Usar solo en el caso de ausencia de alternativas terapéuticas más seguras.
Se recomienda suspender la lactancia materna y reanudarla 48 horas después del final del tratamiento o evitar la administración del medicamento. |
| Moxifloxacino | GI (náusea, diarrea), hipoglucemia, efectos sobre el SNC (agitación, nerviosismo, desorientación, alteraciones de la memoria, insomnio, mareo). Raro: neuropatía periférica, rotura de tendón, prolongación del QT | Considerar ECG, signos de hipoglucemia, efectos del SNC. | Hemograma, ALT y creatinina (al mes, 3 meses y anualmente). | Adenosina, amiodarona, citalopram, dabrafenib, delamanid, escitalopram, hidroquinidina, hidroxizina, ivabradina, nitrofurantoína, mizolastina, procainamida, ribociclib, salmonella typhi, sotalol, sunitinib, tiaprida, vemurafenib, | Contraindicado durante el embarazo y lactancia. |
| Rifampicina | Cambio en el color de los fluidos (rojo/naranja), efectos cutáneos (rash, prurito), efectos GI (náusea, vómito), hepatitis, toxicidad hematológica (leucopenia, anemia hemolítica). Raro: síndrome pseudogripal. | Monitorizar la interacción entre fármacos, efectos cutáneos y GI. | Hemograma, ALT, Creatinina (al mes y luego cada 3 meses). | atazanavir, bosentan, bosutinb, ciclosporina,
clopidogrel, cobimetinib, crizotinib, dasatinib, dolutegravir, doravirina, doxiciclina, enalapril, esomeprazol, estradiol, everolimus,fluconazol, gefitinib, itraconazol, ivacaftor,midazolam, omeprazol, pirfenidona, remdesivir, roflumilast, tezacaftor, vancomicina, voriconazol, Warfarina, |
Contraindicado en embarazo.
Se excreta en cantidades pequeñas en la leche pero se desconoce su efecto. |
| Abreviatura GI; gastrointestinal, ECG; electrocardiograma, SNC; sistema nervioso central, F.A., fosfatasa alcalina
· En función del paciente considerar revisión mensualmente hasta el tercer mes para ver efectos secundarios y cumplimiento. |
|||||
Bibliografía
[1] Hernández Borje, J., García García M.C., Antona Rodriguez M.J., Sanz Cabrera A. Capítulo 48 Enfermedad por micobacterias ambientales. Micosis pulmonares. Manual de Diagnóstico y terapéutica en neumología. 3ª edición., 2016.
[1] Daley C.L., Laccarino J.M,, Lange C., Cambau E., Wallace R.J., Andrejak C., et al. Treatment of Nontuberculous Mycobacterial Pulmonary Disease: An Official ATS/ERS/ESCMID/IDSA Clinical Practice Guideline. Clinical Infectious Diseases 2020; 71 (4):905-13.
[1] Yagi K., Morimoto K., Ishii M., Namkoong H., Okamori S., Asakura T. et al. Clinical characteristics of pulmonary Mycobacterium lentiflavum disease in adult patients. International Journal of Infectious Diseases 67 (2018) 65-69.
Griffit DE, Aksamit T, Brown-Elliott BA, Catanzaro A, Daley C, Gordin F el al. Am J Respir Crit Care Med. 2007 Feb 15;175(4):367-416.
Clinical Guidelines: Care of Children with Cystic Fibrosis Royal Brompton Hospital. 2017. 7th edition. Available on www.rbht.nhs.uk/childrencf
Guidelines for the treatment of Non- Tuberculous micobacteria in patients with cystic fibrosis. 2012
Haworth C, Banks J, Capstick J,Fisher AJ, Gorsuch T, Laurenson I, et al. British Thoracic Society guidelines for the management of non-tuberculous mycobacterial pulmonary disease (NTM-PD). Thorax . 2017 Nov;72(Suppl 2)
https://www.seipweb.es/dosisantibióticos/