En el paciente con neumonía grave sin ventilación mecánica, el cultivo de esputo es la técnica más utilizada. Sin embargo, la obtención correcta de la muestra es crucial para poder determinar si los microorganismos aislados corresponden al verdadero agente etiológico y no a flora colonizante de vías superiores. Los pacientes con neumonía asociada a ventilación mecánica (NAVM) presentan generalmente un grado de colonización elevado en sus vías respiratorias superiores (tráquea y bronquios principales) que va a dificultar la interpretación de los resultados microbiológicos. En este tipo de pacientes la obtención de un aspirado traqueal para cultivo cualitativo equivale al esputo en el paciente no ventilado, y se ha mostrado como una técnica muy fácil, con una alta sensibilidad pero con un valor predictivo positivo muy escaso, por el problema de la imposibilidad de diferenciar la flora derivada de colonización de la flora verdaderamente responsable de la infección pulmonar.
Para obviar el problema de la contaminación de las muestras respiratorias con la flora de colonización de las vías respiratorias superiores, utilizaremos muestras de lavado bronco-alveolar (LBA) obtenidas mediante fibrobroncoscopia. Se ha demostrado que la rentabilidad del cultivo microbiológico es mayor en muestras obtenidas por procedimientos invasivos que mediante procedimientos no invasivos. Además, se ha demostrado que el realizar técnicas moleculares rápidas en muestras respiratorias de alta calidad, como las obtenidas mediante fibrobroncoscopia, presenta una mayor rentabilidad diagnóstica.
En base a lo anterior, en el programa PDT precoz se incluirán dos algoritmos diagnósticos, uno centrado en neumonía en pacientes con inmunosupresión grave, y otro para pacientes con neumonía grave (CURB 65 ≥ 3) y NAVM.
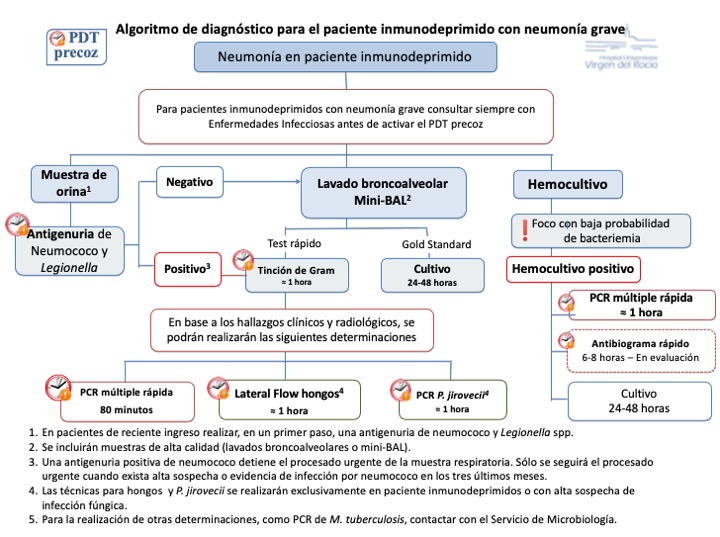
Algoritmo 1: PDT precoz neumonía en pacientes con inmunosupresión grave.
Algoritmo 2: PDT precoz neumonía grave (CURB 65 ≥ 3) y NAVM.
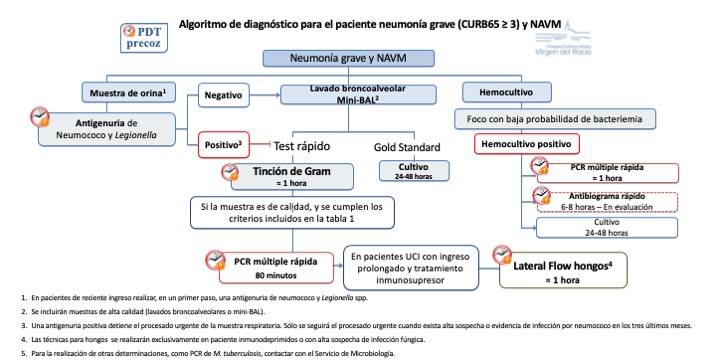
En los pacientes de reciente ingreso, se recomienda realizar en primer lugar una determinación de antigenuria de Streptococcus pneumoniae y Legionella spp. Adicionalmente, se recomienda la toma de hemocultivos. La recogida de la muestra debe realizarse de acuerdo a los especificado en el apartado de _enlace- Sepsis/shock séptico del programa DPT precoz.
*Tabla* Puntos clave sobre el programa PDT precoz en pacientes con neumonía:
| 1. Solo se incluirán muestras de lavado broncoalveolar debido al alto riesgo que supone el implementar técnicas moleculares en muestras de mala calidad, con posibles resultados falsos positivos y uso de tratamientos inadecuados. |
| 2. Las técnicas moleculares rápidas no deben solicitarse como control de tratamiento, ya que al detectar ADN, puede que ya no existan bacterias viables y la infección esté resuelta, pero la PCR seguirá detectando la presencia de material genético. Por ello, no deben solicitarse si el paciente ya presenta un cultivo de muestra respiratoria con aislamiento en los 3-5 días previos. |
| 3. Las técnicas moleculares rápidas no deben solicitarse para realizar barridos microbiológicos, ya que cuanto menor sea la probabilidad pre-test, mayor será la probabilidad de obtener un resultado falso positivo. |
| 4. La determinación de galactomanano rápido solo se realizará en pacientes inmunodeprimidos. |
| 5. La determinación de Pneumocystis jirovecii deberá ser solicitada por el Servicio de Enfermedades Infecciosas. |
Bibliografía:
- Cacho Calco JB, Meseguer Peinado MA, Oliver Palomo A, Puig de la Bellacas J. Diagnóstico microbiológico de las infecciones bacterianas del tracto respiratorio inferior. ociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), 2007.
- Torres A, Niederman MS, Chastre J et al. International ERS/ESICM/ESCMID/ALAT guidelines for the management of hospital-acquired pneumonia and ventilator-associated pneumonia: Guidelines for the management of hospital-acquired pneumonia (HAP)/ventilator-associated pneumonia (VAP) of the European Respiratory Society (ERS), European Society of Intensive Care Medicine (ESICM), European Society of Clinical Microbiology and Infectious Diseases (ESCMID) and Asociación Latinoamericana del Tórax (ALAT). Eur Respir J. 2017; 50(3):1700582. doi: 10.1183/13993003.00582-2017.
- Ranzani OT, Senussi T, Idone F et al. Invasive and non-invasive diagnostic approaches for microbiological diagnosis of hospital-acquired pneumonia. Crit Care. 2019; 23(1):51. doi: 10.1186/s13054-019-2348-2.
- Murphy CN, Fowler R, Balada-Llasat JM et al. Multicenter Evaluation of the BioFire FilmArray Pneumonia/Pneumonia Plus Panel for Detection and Quantification of Agents of Lower Respiratory Tract Infection. J Clin Microbiol. 2020; 58(7):e00128-20. doi: 10.1128/JCM.00128-20.
- White PL, Price JS, Posso R et al. Evaluation of the Performance of the IMMY sona Aspergillus Galactomannan Lateral Flow Assay When Testing Serum To Aid in Diagnosis of Invasive Aspergillosis. J Clin Microbiol. 2020; 58(6):e00053-20. doi: 10.1128/JCM.00053-20.
- Huber T, Serr A, Geißdörfer W et al. Evaluation of the Amplex eazyplex Loop-Mediated Isothermal Amplification Assay for Rapid Diagnosis of Pneumocystis jirovecii Pneumonia. J Clin Microbiol. 2020 Nov 18;58(12):e01739-20. doi: 10.1128/JCM.01739-20. PMID: 32938732; PMCID: PMC7685886.